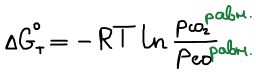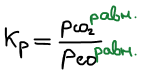Химическое равновесие
Химическое равновесие — состояние системы, соответствующее минимуму значения энергии Гиббса. В состоянии равновесия изменение энергии Гиббса химической реакции равно нулю (ΔG = 0).
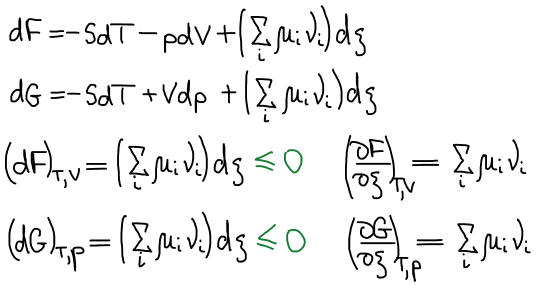
Условия химического равновесия

Вывод уравнения изотермы Вант-Гоффа
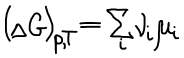
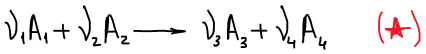
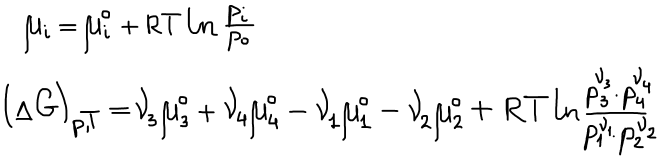
Уравнение изотермы Вант-Гоффа для реакции (★)
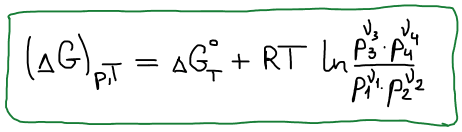
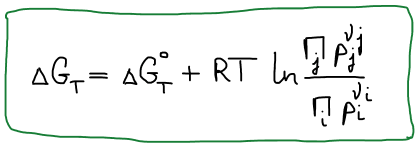
В состоянии равновесия ΔGT = 0
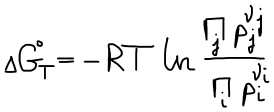
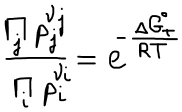
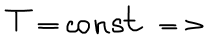
Правая часть постоянна, значит левая часть тоже постоянна. Эта постоянная называется константой равновесия.
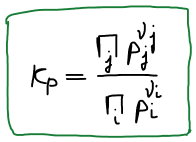
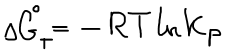
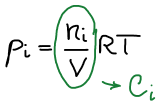
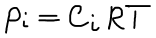
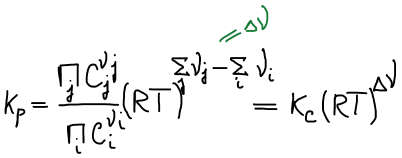
Связь Kp и Kc
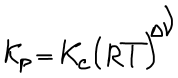
Закон Дальтона:
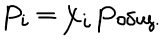
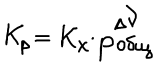
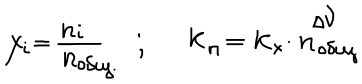
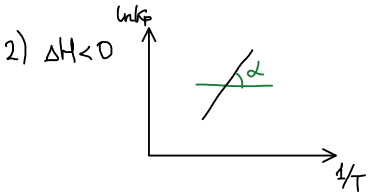
Влияние температуры на положение равновесия
Уравнение Гиббса-Гельмгольца:
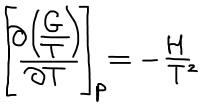
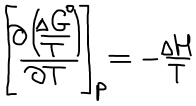
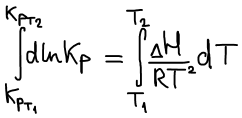
Уравнение изобары Ван-Гоффа
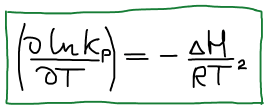
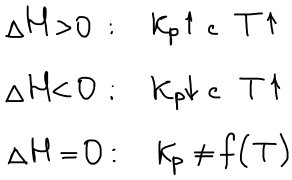
Уравнение изобары Ван-Гоффа будем использовать, чтобы рассчитать КT2 если известна KT1
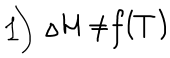
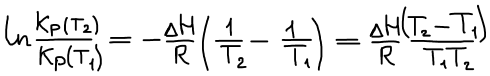
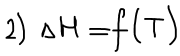
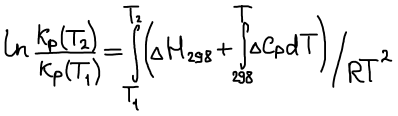
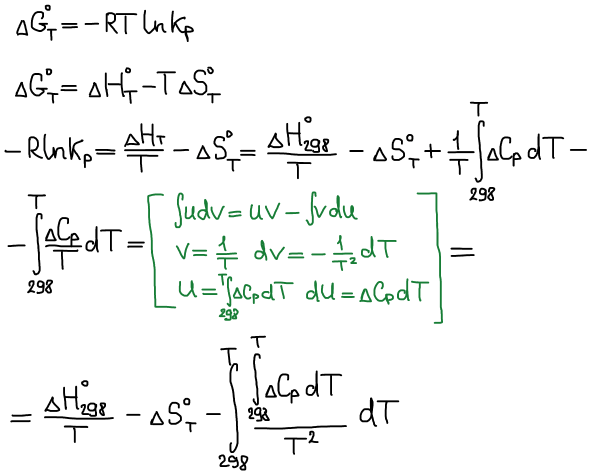
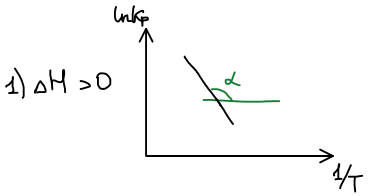
Графическое изображение зависимости Кр от Т:
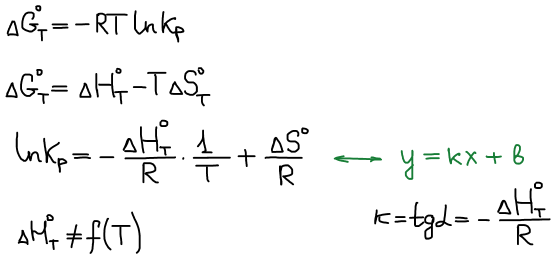
Влияние давления на положение равновесия:
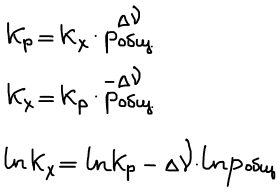

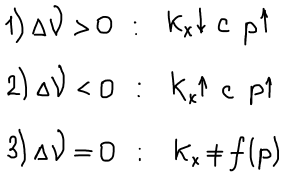
Влияние добавок инертного газа:
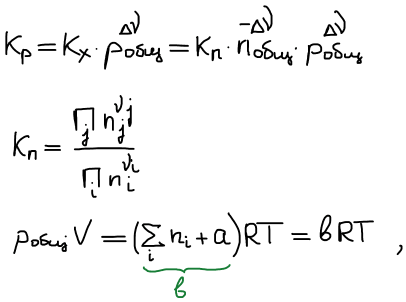
где а — число моль добавленного инертного газа.
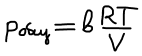
- инертный газ добавляется в систему при постоянстве V, T
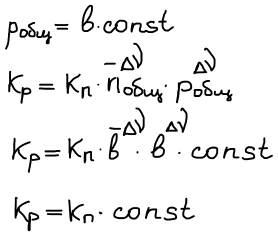
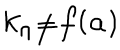
Не является функцией добавок инертного газа, положение равновесия безразлично к добавке инертного газа.
- инертный газ добавляется в систему при постоянстве p, T
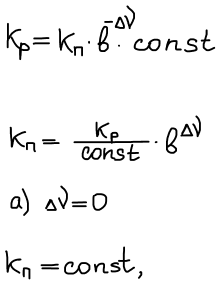
т.к. Кр не зависит от добавки
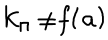


Химическое равновесие в гетерогенных реакциях с участием газообразных веществ
Гетерогенные реакции — это такие реакции, в которых участники принадлежат различным фазам
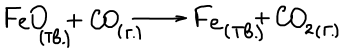
Химический потенциал твердой фазы не зависит от давления, а зависит только от температуры, следовательно уравнение изменения функции Гиббса для реакции, протекающей на 1 шаг запишется в следующем виде:
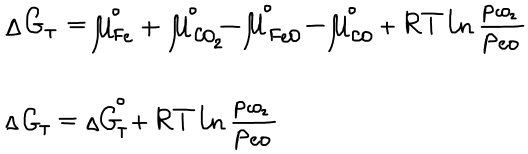
В состоянии равновесия ΔG T = 0