Основные определения физической химии
Предметом физической химии является установление основных закономерностей и принципов, которым подчиняются физические и химические процессы с участием вещества.
Физическим процессом называют такие процессы, которые протекают без изменения внешних (валентных) электронных оболочек атома вещества. А химические процессы — с изменением.
Также предметом физической химии является установление взаимосвязей между изменением энергии и протеканием физических и химических процессов.
Задачи, решаемые физической химией:
- установление направления, в котором протекают все процессы (определение критериев направленности процессов);
- установление того, на какую глубину протекают все процессы (определение критериев достижения предельной глубины протекания процессов);
- установление скорости и механизма протекания процессов;
- установление фундаментальной взаимосвязи в цепочке: состав - структура - свойства вещества.
Методы физической химии:
- феноменологический (термодинамический);
- статистический;
- квантово-механический.
В результате применения различных методов для решения задач физическая химия разделилась на несколько дисциплин:
- Химическая термодинамика;
- Кинетика и катализ;
- Электрохимия;
- Кристаллохимия;
- Коллоидная химия;
- Физическая химия ВМС;
- Квантовая химия и строение вещества;
- Статистическая термодинамика.
Термодинамическая система — совокупность материальных тел, находящихся внутри заданной границы раздела. Границы могут быть реальными (физическими), а могут быть воображаемыми.
Термодинамическая система состоит из огромного числа частиц. Все что находится за пределами границы — окружающая среда.
Виды систем:
- Изолированная. Не обменивается с окружающей средой ни веществом, ни энергией. Границы абсолютно непроницаемы.
- Открытая. Обменивается с окружающей средой как веществом, так и энергией.
- Закрытая. Не обменивается с окружающей средой веществом, но обменивается энергией.
Закрытые системы разделяют на:
- адиабатические - не обмениваются с окружающей средой веществом, теплотой, а обмениваются только работой;
- замкнутые - не обмениваются с окружающей средой веществом, работой, а обмениваются только теплотой.
Энергия — это количественная мера различных форм движения.
Полная энергия системы — сумма кинетической и потенциальной энергий взаимодействия различных частиц системы.
Формы изменения энергии:
- Упорядоченная (работа);
- Неупорядоченная (теплота).
В учебниках работа обозначается по-разному: А (немец. arbeit), W (англ. work). Мы будем обозначать работу буквой W.
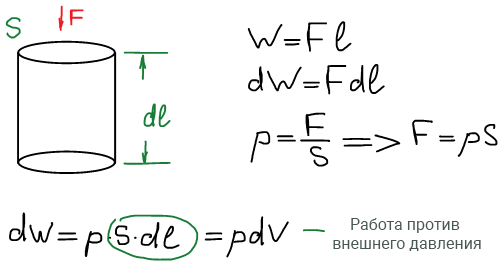

Температура — количественная мера степени нагретости вещества.
- 1597 г. Галилео Галилей изобрел термоскоп. Температура измерялась не количественно, т.к. не было единиц измерений.
- 1701 г. Исаак Ньютон: шкала в 12 делений (от температуры замерзания воды до температуры “здорового мужчины”.
- 1715 г. Даниель Габриель Фаренгейт предложил свою единицу измерений: 0 °F — температура таяния смеси снега и поваренной соли, 32 °F — температура таяния льда, 96 °F — температура “здорового мужчины”.
- Затем Андерс Цельсий предложил шкалу, в которой температура плавления льда принималась за 100 °С, а температура кипения воды за 0 °. В 1745 г. Шкала была перевернута Карлом Линеем и в таком виде используется до нашего времени.
- 1848 г. Уильям Томсон (лорд Кельвин) пишет в своей работе «Об абсолютной термометрической шкале» о необходимости шкалы, нулевая точка которой будет соответствовать предельной степени холода (абсолютному нулю), а ценой деления будет градус Цельсия.
- 1954 — международная шкала температур Цельсия.
1939 г. Фаулер сформулировал принцип транзитивности (перенесение) химического равновесия (иногда его называют нулевым началом термодинамики): Если два тела А и B независимо друг от друга находятся в термическом равновесии с третьим телом C, то они находятся в термическом равновесии друг с другом.
Параметр системы — это физическое свойство системы, заданное количественно.
1813г. Гегель “Наука логики”
Эстенсивное свойство определяется через само себя.
Экстенсивное свойство — такое свойство системы, которое характеризует систему в целом и обладает принципом аддитивности. Экстенсивное свойство системы складывается из значений этого свойства для отдельных подсистем, на которое эта система раскладывается.
Интенсивное свойство — такое свойство, которое не обладает принципом аддитивности и определяется в окрестностях некоторой точки, выбранной внутри системы.
Состояние системы определено, если задан набор параметров с известными значениями.
Термодинамический процесс — любое изменение значений параметров в заданном наборе. Процесс всегда приводит систему с начального состояния в сопряженное с ним конечное
Если процесс переводит систему из начального состояния в конечное так, что начальное состояние совпадает с конечным, то говорят о циклическом процессе.
Состояние равновесия системы определяется тогда, когда значение всех параметров не изменяется во времени и это постоянство параметров не обусловлено протеканием компенсирующих процессов либо в самой системе, либо в окружающей среде.
Истинное состояние равновесия системы имеет необходимое и достаточное условие:
- необходимым условием является условие стационарности. т.е. неизменности значений параметров во времени;
- достаточным условием является достижимость равновесия с нескольких сторон.
Обратимым процессом называется такой процесс, который развивается через последовательность состояний равновесия бесконечно близко примыкающих друг к другу.