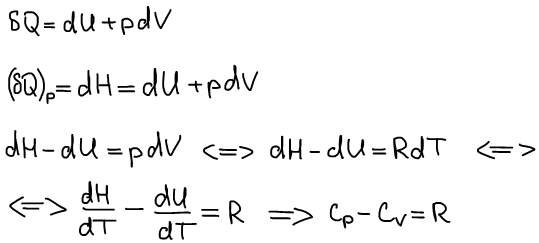Термические уравнения состояния
Уравнение состояние системы — математическая связь между параметрами системы, когда система находится в состоянии равновесия.
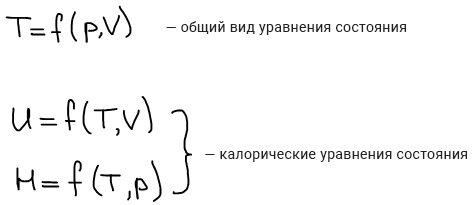
Калорические уравнения позволяют рассчитать такие свойства, которые выражаются в калориях.
1662 г. Роберт Бойль:
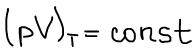
1676 г. Эдмунд Мариотт
1786 г. Жак Александр Сезар Шарль, Жозев Луи Гей-Люссак
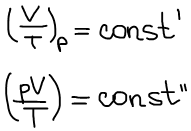
1856 г. Эмиль Клапейрон:

Дмитрий Иванович Менделеев:

Критическая температура газа — температура, выше которой газ не может быть сконденсирован в жидкость, каким бы значительным не было давление.
1873 г. Ван дер Ваальс:

Величину ζ ввел Теофил де Донде в 1922г.

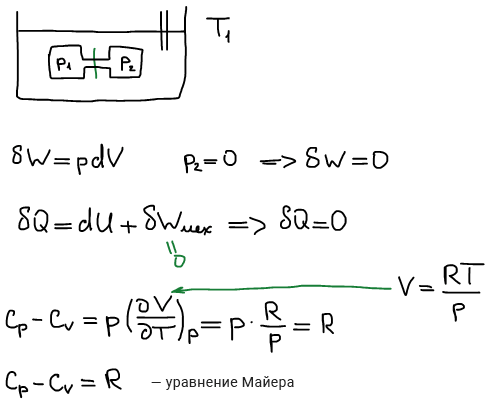
Первое калорическое выражение первого начала термодинамики:
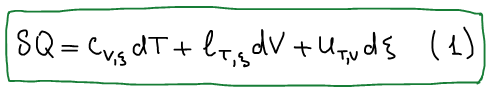
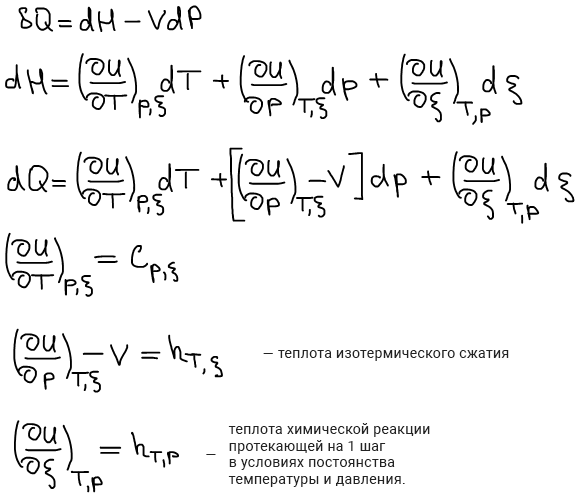
Второе калорическое выражение первого начала термодинамики:

Связь калорических коэффициентовиз 2-х калорических выражений 1 начала термодинамики друг с другом:
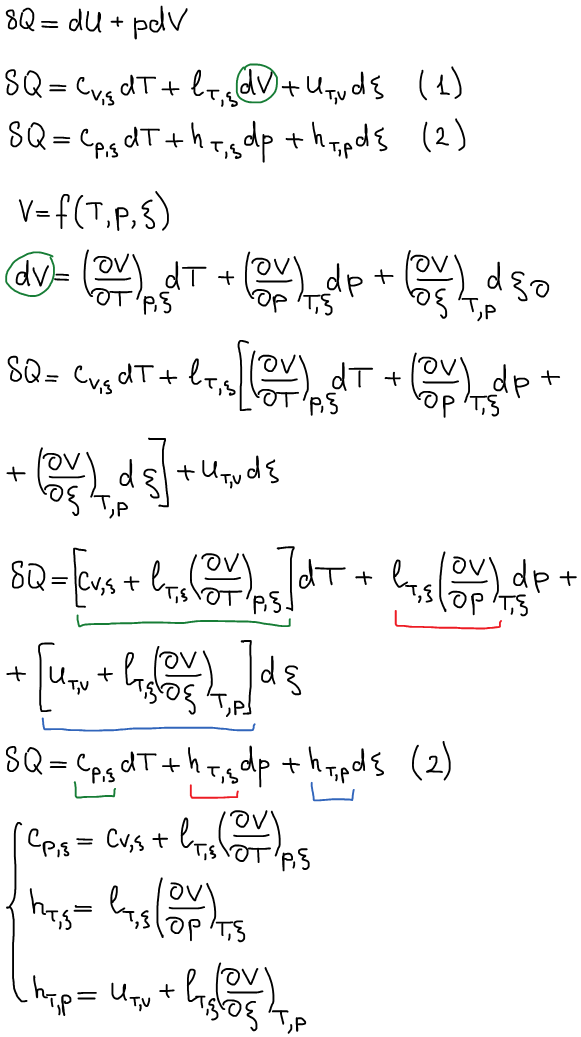
Применение связи между калорическими коэффициентами в термодинамике (допускаем отсутствие химической реакции для простоты):
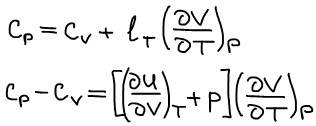
Закон Джоуля
Внутренняя энергия идеального газа зависит только от температуры (т.е. не зависит от давления и объема)