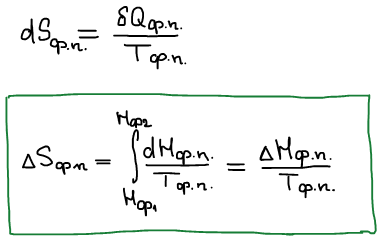
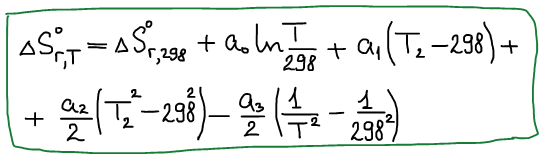Изменение энтропии
Рассмотрим процессы, идущие с участием идеального газа.

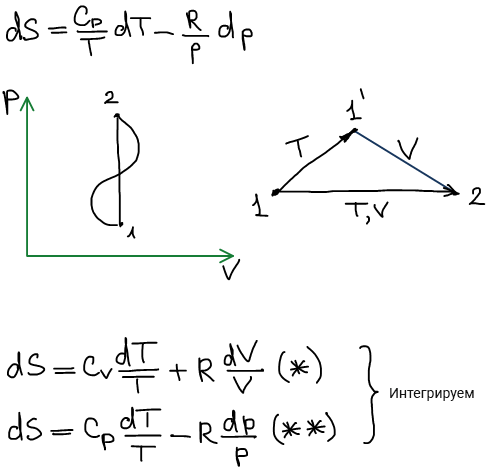
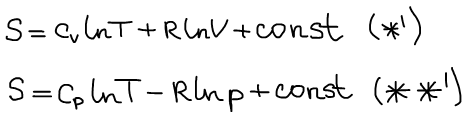
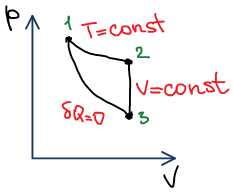
Графическое представление зависимости энтропии.
D координатах p-V (не информативно)^
Для информативности данные зависимости представляются в логарифмических координатах:
1) в координатах S - ln(T)
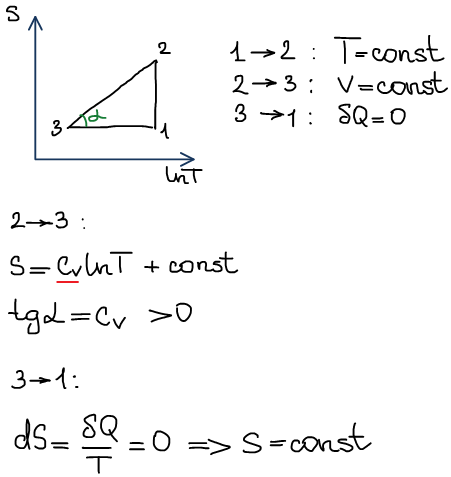
2) в координатах S - ln(V)
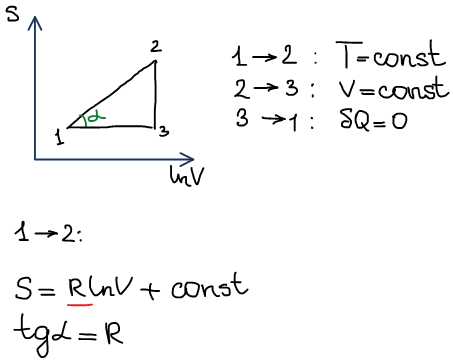
3) в координатах S-ln(p)
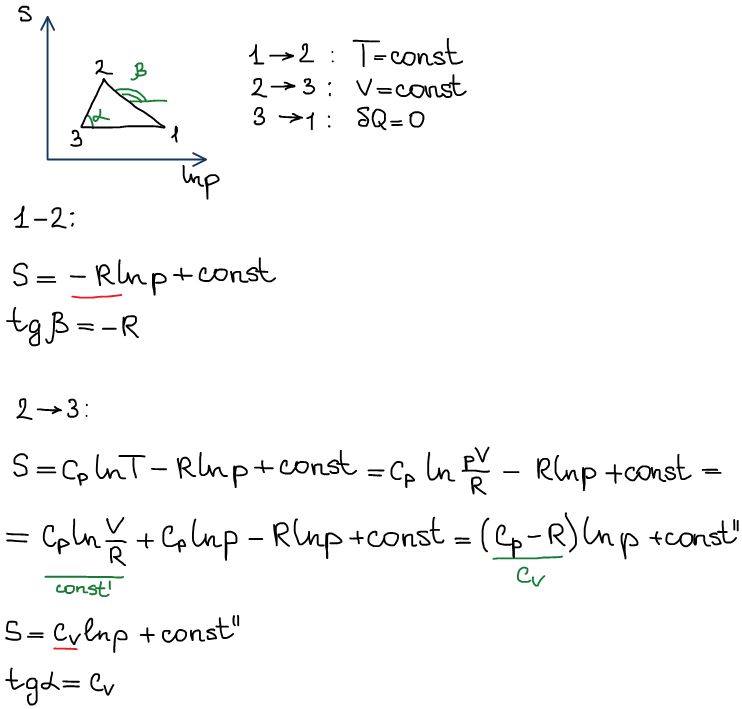
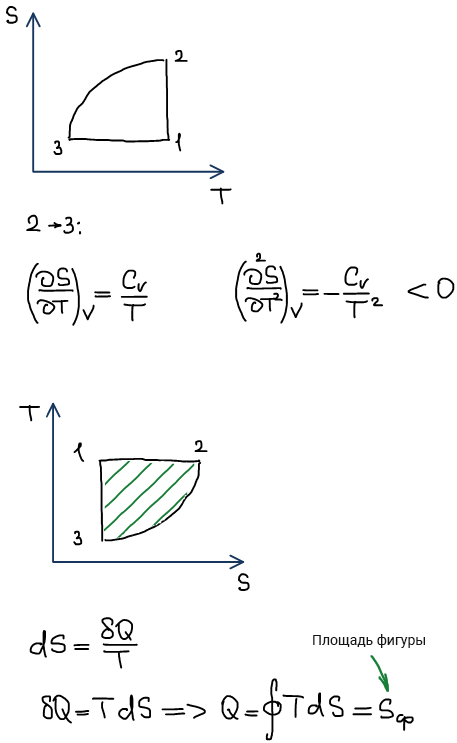
Изменение энтропии в частных процессах с участием реальных газов
Уравнение Ван дер Ваальса:
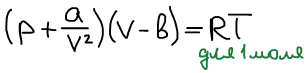
Рассчитать изменение энтропии при изотермическом расширении газа Ван дер Ваальса от объема V1 до объема V2.
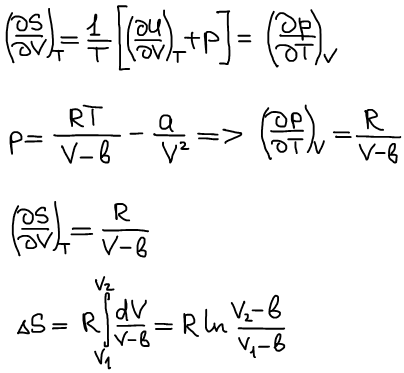
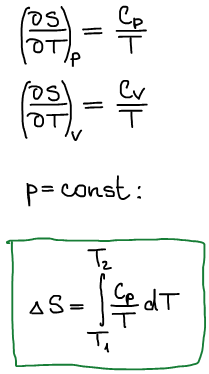
Изменение энтропии при нагревании и фазовых переходах индивидуальных веществ
При нагревании:
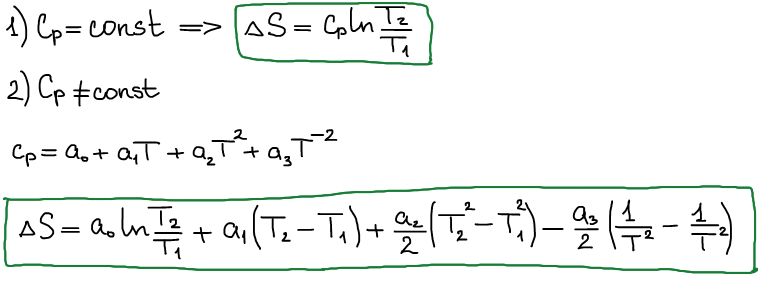
При фазовых переходах:
Понятие “фаза” ввел Джозайя Уиллард Гиббс в 1875 г. в работе “О равновесии в гетерогенных веществах”.
Фаза — гомогенная часть гетерогенной системы, отделенная от других частей физической границей раздела и имеющая либо неизменный состав и свойства, либо монотонно изменяющиеся.
При постоянстве внешнего давления все обратимые фазовые переходы осуществляются при постоянстве температуры.
Изменение энтропии при смешении идеального газа
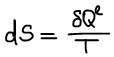
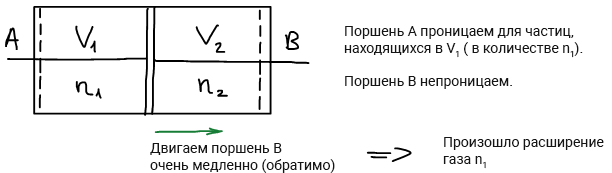
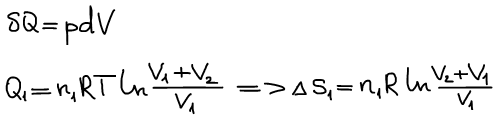
Двигаем поршень A
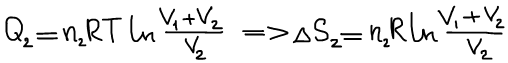
Произошло смешение:
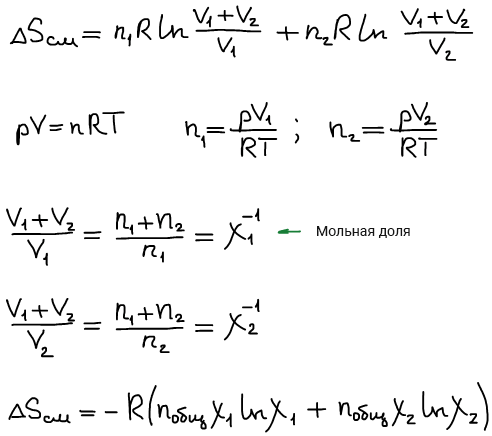
Формула изменения энтропии при идеальном смешении:
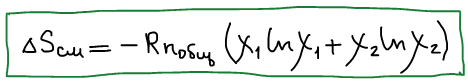
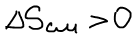
Изменение энтропии при протекании химической реакции